revisión
La displasia del desarrollo de la cadera puede predisponer a osteoartritis: de la inflamación a la destrucción.
Revisión de la literatura
Developmental dysplasia of the hip may predispose to osteoarthritis:
From inflammation to destruction. A literature review
Jorge Alvarado-García1 Liliana García-Ortiz2
Liliana García-Ortiz2 José Gutiérrez-Salinas3
José Gutiérrez-Salinas3 Tania Jazmín Ruiz-Sánchez4
Tania Jazmín Ruiz-Sánchez4
1 Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado, Hospital Regional de Puebla, Servicio de Traumatología y Ortopedia, Puebla, México.
2 Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado, Centro Médico Nacional 20 de Noviembre, División de Medicina Genómica, Ciudad de México, México.
3 Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado, Centro Médico Nacional 20 de Noviembre, División de Investigación Biomédica, Laboratorio de Bioquímica y Medicina Experimental, Ciudad de México, México.
4 Universidad Nacional Autónoma de México, Facultad de Estudios Superiores Cuautitlán, Licenciatura en Bioquímica Diagnóstica, Estado de México, México.
Open access
Recibido: 17/04/2023
Aceptado: 4/05/2023
Correspondencia: Liliana García Ortiz. División de Medicina Genómica, Centro Médico Nacional 20 de Noviembre, Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado, Ciudad de México, México Correo electrónico: garortiz@yahoo.com.
Cómo citar: Alvarado-García J, García-Ortiz L, Gutiérrez-Salinas J, Ruiz-Sánchez J. [La displasia del desarrollo de la cadera puede predisponer a osteoartritis: de la inflamación a la destrucción. Revisión de la literatura]. Rev Col Or Tra. 2023;37(2):e19. English. doi: https://doi.org/10.58814/01208845.19
How to cite: Alvarado-García J, García-Ortiz L, Gutiérrez-Salinas J, Ruiz-Sánchez J. Developmental dysplasia of the hip may predispose to osteoarthritis: From inflammation to destruction. A literature review. Rev Col Or Tra. 2023;37(2):e19. English. doi: https://doi.org/10.58814/01208845.19
Copyright: ©2023 Sociedad Colombiana de Cirugía Ortopédica y Traumatología. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Atribución, la cual permirte el uso, distribución y reproducción sin restricción alguna en cualquier medio, siempre que se den los créditos al autor y la fuente.
Resumen
Introducción. La displasia del desarrollo de la cadera (DDC) abarca un conjunto de anormalidades relacionadas con el proceso de maduración del acetábulo y del tercio proximal del fémur Si no se trata de manera adecuada y oportuna, los pacientes con esta condición pueden desarrollar osteoartritis (OA) eventualmente.
Objetivo. Recopilar y sintetizar evidencia científica publicada entre enero de 2000 y febrero de 2023 sobre la fisiopatología de la DDC y su relación con el desarrollo de OA de cadera en términos de los mecanismos fisiopatológicos genéticos, inflamatorios e inmunológicos.
Materiales y métodos. Se realizó una revisión de la literatura en bases de datos de literatura biomédica (PubMed/Medline, Embase, SciELO) y herramientas bioinformáticas (e-Ensambl, STRING), mediante términos como “displasia de cadera”, “osteoartritis”, “etiología” y “genes”. Se incluyeron estudios observacionales clínicos y genéticos realizados en humanos.
Resultados. La búsqueda inicial arrojó 349 registros, de los cuales 23 cumplieron los criterios de elegibilidad. Los genes que interactúan con módulos genéticos parecen participar en el desarrollo articular y la etiología de las enfermedades relacionadas con el cartílago y el hueso; sin embargo, la inestabilidad mecánica producida por la DCC activa factores inflamatorios e inmunológicos, predisponiendo OA. A partir de la información encontrada, se puede considerar que existe una relación muy estrecha entre DDC y OA.
Conclusiones. Conocer los mecanismos fisiopatológicos genéticos, inflamatorios e inmunológicos de DDC y OA favorece la realización de un diagnóstico oportuno y, en consecuencia, posibilita brindar un tratamiento adecuado para disminuir y controlar el daño a largo plazo y mejorar la calidad de vida del paciente.
Palabras clave: Displasia del desarrollo de la cadera; Osteoartritis; Genes, Inflamación; Inmunología (DeCS).
Abstract
Introduction: Developmental dysplasia of the hip (DDH) encompasses a set of abnormalities related to the maturation process of the acetabulum and the proximal third of the femur. If not treated properly and promptly, patients with this condition may eventually develop osteoarthritis (OA).
Objective: To compile and synthesize scientific evidence published between January 2000 and February 2023 on the pathophysiology of DDH and its relationship to the development of hip OA in terms of genetic, inflammatory and immunological pathophysiological mechanisms.
Methodology: A literature review was performed in biomedical literature databases (PubMed/Medline, Embase, SciELO) and bioinformatic resources (e-Ensambl, STRING), using terms such as "hip dysplasia", "osteoarthritis", "etiology", and "genes". Clinical and genetic observational studies involving human subjects were included.
Results: The initial search yielded 349 records, of which 23 met the eligibility criteria. Genes that interact with genetic modules may play a role in the development of joints and the etiology of diseases that affect the bones and cartilage; however, the mechanical instability caused by DDH activates inflammatory and immunological factors, predisposing to OA. Based on the information obtained, it is possible to consider that there is a very close relationship between DDH and OA.
Conclusions: Knowing the genetic, inflammatory and immunological pathophysiological mechanisms of DDH and OA favors timely diagnosis and, consequently, allows providing proper treatment to reduce and control long-term damage and improve the patient's quality of life.
Keywords: Development Dysplasia of the Hip; Osteoarthritis; Genes; Inflammation; Immunology (MeSH).
Introducción
La displasia del desarrollo de la cadera (DDC) se refiere a un conjunto de anormalidades relacionadas con el proceso de maduración del acetábulo y del tercio proximal del fémur, que pueden ocurrir durante etapa embriológica, fetal o infantil.1,2 Dichas alteraciones comprenden desde la inestabilidad de la cadera y la displasia del acetábulo y/o de la cabeza femoral hasta la subluxación o luxación de la cabeza femoral.1,2 Si la DDC no se diagnostica de manera adecuada y no se corrige, con el paso del tiempo causa osteoartritis (OA), una enfermedad degenerativa caracterizada por el desgaste del cartílago articular, la formación de osteofitos y la deformación articular que se manifiesta en alteraciones de la marcha (como limitación de la amplitud) y dolor mecánico crónico.1,3,4
En la actualidad, la etiología de la DDC es desconocida; sin embargo, se han descrito varios factores de riesgo relacionados tales como factores mecánicos (presentación podálica al nacimiento, oligohidramnios, hiperlaxitud ligamentaria, deformidad del miembro inferior o afectación del lado izquierdo del bebé en el vientre), hereditarios (familiares de primer grado e hijos primogénitos con DDC, o embarazo múltiple), demográficos (sexo femenino) y genéticos, como la presencia de variantes, elementos reguladores, potenciadores relativos al promotor del gen del factor de diferenciación del crecimiento 5 (GDF5), el cual codifica para un ligando asociado a la familia del factor de crecimiento transformante beta (TGF-β). Estos ligandos son capaces de unirse a receptores TGF-β para reclutar y activar factores de transcripción llamados SMAD que regulan la expresión génica, por lo que participan en el desarrollo normal del hueso y de la articulación, ya que pueden iniciar la condrogénesis y la osteogénesis a través de la proliferación del cartílago epifisiario. En este sentido, se ha reportado que las mutaciones en el gen GDF5 están asociadas a varios tipos de displasias y sinostosis, así como a la susceptibilidad del individuo a padecer OA.1,5-7
La prevalencia de la OA de cadera oscila entre 0,37% y 27%, dependiendo de la edad, el sexo, el lugar de procedencia y el grado de afectación. Al respecto, la prevalencia de OA de cadera más alta se ha descrito en los norteamericanos y la más baja en los latinoamericanos (Tabla 1).8-12
Tabla 1. Prevalencia y edad de ocurrencia de osteoartritis de cadera reportada en la literatura.8-12
|
Prevalencia de osteoartritis de cadera
|
Edad (en años)
|
Lugar de procedencia
|
Referencia
|
|
27%
|
45
|
Estados Unidos
|
Lespasio MJ et al.8
|
|
7 - 25 %
|
55
|
Europa
|
Lievense AM. et al.9
|
|
9,6% - 18%
|
60
|
Mundial
|
Leung Y. et al.10
|
|
6,8%
|
65
|
Asia
|
Fransen M. et al.11
|
|
0,37% - 26,5%
|
18-40
|
Latinoamérica
|
Andrade et al.12
|
Fuente: elaboración propia.
Varias investigaciones y estudios clínicos y genéticos han encontrado una correlación entre DDC y OA.13-16 Por ejemplo, Terjesen13 describió en pacientes pediátricos que aquellos con DDC y subluxación tenían un mayor factor de riesgo de desarrollar OA de cadera cuando la cirugía reconstructiva se realizaba de manera tardía. De acuerdo con Terjesen13, en un estudio realizado por Wiberg en 17 caderas con displasia acetabular o subluxación, se identificó una asociación entre la edad y el grado de severidad de la OA de cadera, puesto que las medias de edad de diagnóstico de OA en las mujeres fueron 41 años en pacientes con subluxación y 53 años en aquellas con displasia acetabular sin subluxación. Además, Mabuchi et al.16 encontraron que 8 pacientes pertenecientes a 4 generaciones de una familia japonesa presentaron displasia acetabular en la adolescencia y OA de cadera a los ∼40años, lo que sugiere herencia autosómica dominante.
Por otro lado, de acuerdo con Hatzikotoulas et al,6 aunque no hay una relación directa entre DDC y OA, los estudios de asociación mediante rastreo genómico (GWAS, por su sigla en inglés) han demostrado que estas dos enfermedades comparten genes como el gen GDF5 y genes que codifican para algunas citocinas y citocinas proinflamatorias.
En estudios experimentales en ratones se ha identificado que durante la formación de la articulación se presenta una mayor densidad celular en el sitio de la futura articulación, denominada interzona. Las células de la interzona se caracterizan por ser Gdf5 positivas y por conservar un flujo ininterrumpido espaciotemporal con el fin de poder participar en el desarrollo de la articulación. De esta forma, las observaciones experimentales del Gdf5 en células de la interzona que están relacionadas con el favorecimiento de la regeneración articular pueden ser un punto de partida para favorecer su aplicación clínica. Sin embargo, es importante mencionar que se ha descrito que estas células presentan de manera natural una capacidad limitada de regeneración, por lo que se necesitan más estudios que permitan evidenciar los mecanismos regenerativos en la OA.17
Además, se ha observado que la OA de cadera inicia con un daño en el cartílago, hueso y/o tejido sinovial, es generada por una serie de microtraumas secundarios a la inestabilidad biomecánica de la articulación (subluxación y/o luxación de la cadera) y está favorecida por mecanismos genéticos, inmunológicos e inflamatorios que en conjunto contribuyen a la formación de un microambiente de componentes regulatorios, los cuales llevarán a la destrucción de la articulación de la cadera a corto o mediano plazo.16,17
Teniendo en cuenta lo anterior, el objetivo de esta revisión narrativa de la literatura fue recopilar y sintetizar evidencia científica publicada entre enero de 2000 y febrero de 2023 sobre la fisiopatología de la DDC y su relación con el desarrollo de OA de cadera en términos de los mecanismos fisiopatológicos genéticos, inflamatorios e inmunológicos.
Materiales y métodos
La búsqueda de publicaciones se realizó en las bases de datos PubMed/Medline, SciELO y Embase para artículos sobre el tema, y en las herramientas bioinformáticas e-Ensambl y STRING para investigaciones sobre genes específicos que fueron identificados previamente en la literatura biomédica.
El proceso de búsqueda de los artículos estuvo a cargo de uno de los autores, mientras que la revisión para su inclusión final fue realizada por un segundo autor; ambos procesos se llevaron a cabo de manera independiente, aleatoria y libre. Se utilizó la siguiente estrategia de búsqueda: tipos de estudio: estudios clínicos o genéticos, reportes de caso, estudios observacionales y revisiones sistemáticas; periodo de publicación: enero de 2000 y febrero de 2023; idioma de publicación: español o inglés; términos de búsqueda: “congenital hip dysplasia”, “hip”, “osteoarthritis”, “etiology”, “genetics factors”, “genes”, “gene expression”, “GWAS”, “proteomic”. Se incluyeron los estudios realizados en humanos e investigaciones realizadas con modelos experimentales.
Es importante mencionar que se excluyeron todos los artículos que no eran de libre acceso o en los que no fue posible acceder al texto completo mediante los convenios del sistema de bibliotecas de la institución, así como los artículos cuyo tipo de estudio fuera distinto a los mencionados anteriormente, los que estaban escritos en un idioma diferente al español o inglés, aquellos que no abordaran el tema de interés de la revisión (por ejemplo, investigaciones sobre osteoartritis en una región distinta a la cadera o sobre genes no asociados con las enfermedades en cuestión) y aquellos realizados en población pediátrica.
Resultados
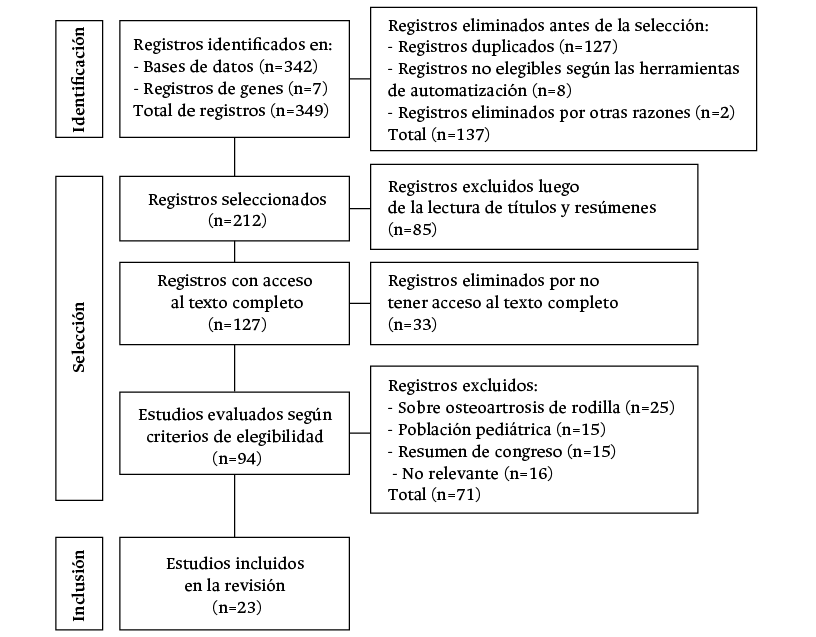
La búsqueda inicial arrojó 349 registros, de los cuales se descartaron 127 registros duplicados, 8 que fueron identificados como no elegibles según las herramientas de automatización y 2 por otras razones. De los 212 registros seleccionados, se excluyeron 85 luego de la revisión del títulos y resúmenes, y 33 ya que no fue posible acceder al texto completo. De los 94 artículos revisados según los criterios de elección, se descartaron 25 por abordar OA de rodilla, 15 por ser realizados en niños, 15 por ser resúmenes de congreso y 16 por considerarse no relevantes. Por lo anterior, se incluyeron 23 estudios en la presente revisión sistemática. El flujograma de búsqueda y selección de los artículos se presenta en la Figura 1.
Figura 1. Diagrama de flujo de la búsqueda y selección de artículos.
Fuente: elaboración propia.
Mecanismos fisiopatológicos asociados a la displasia del desarrollo de la cadera y osteoartrosis de cadera
Mecanismos genéticos
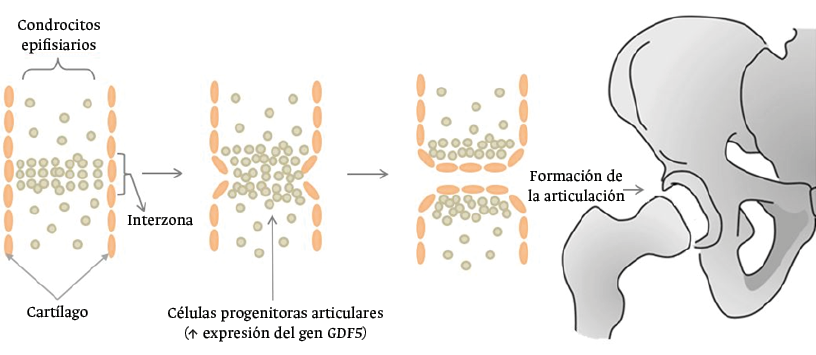
El inicio de la histogénesis de una articulación está presidido por la aparición de un bloque celular llamado interzona, en el cual se encuentra el esbozo de la futura articulación y ocurre la expresión de nuevos genes, entre los que se encuentra el gen GDF5 (Figura 2).17
Figura 2. Formación de la interzona durante la histogénesis articular.
Fuente: elaboración propia.
Estudios realizados en animales de experimentación han mostrado que, en la región proximal de la articulación, existen células que expresan los genes Sox9+, Col2a1+ y Gdf5 que migran a las zonas de formación de la articulación para activar células Gdf5+. De esta forma, se considera que el desarrollo articular está influenciado por dos procesos biológicos conocidos como “hipótesis temporal” e “hipótesis espacial”.17
La hipótesis temporal se refiere a la expresión de células GDF5+ durante el desarrollo temprano de la articulación que contribuyen a la formación de la epífisis. Por su parte, la hipótesis espacial hace referencia a que la localización de estas células progenitoras en la interzona determina el destino final de la estirpe.17 Debido a lo anterior, el constante flujo dinámico de células GDF5+ en la interzona moviliza las células en diferentes patrones espaciotemporales. En este sentido, se considera que esta asimetría espaciotemporal favorece el desarrollo articular en huesos largos, como el húmero y el fémur, en los cuales se ha demostrado que existe una mayor concentración de células GDF5+ en comparación a su contraparte articular.
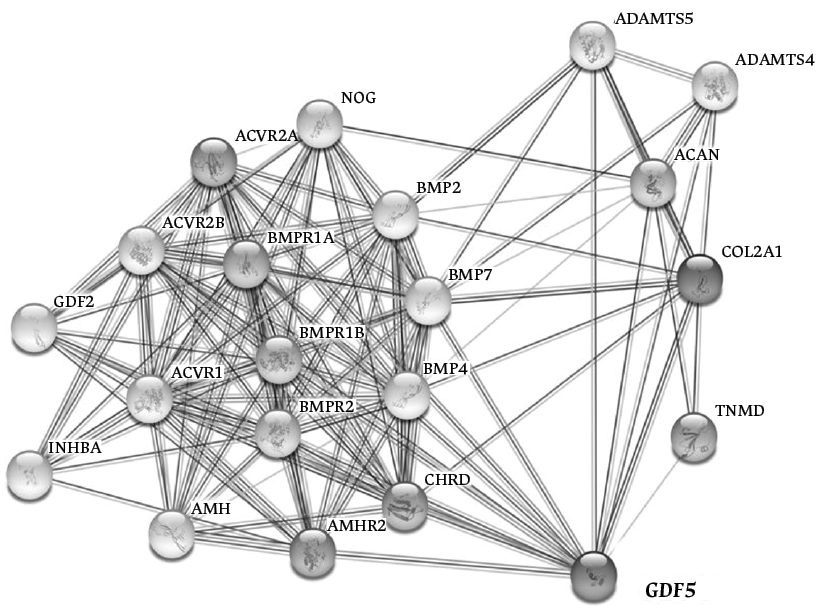
Además, estudios moleculares han demostrado que la existencia de mutaciones en el gen GDF5 pueden afectar el desarrollo del cartílago y el hueso; ya que el GDF5 participa, junto con varios genes, en un interactoma (Figura 3), en donde están involucrados receptores asociados a ligandos que a su vez se unen y activan reguladores transcripcionales (denominados SMAD). Los SMAD son responsables de varios fenómenos relacionados con la embriogénesis de la articulación como la formación del patrón derecho-izquierdo, la morfogénesis del cartílago, la inhibición de la diferenciación de condrocitos, la regulación de las interacciones célula-célula durante inflamación y tumorigenesis, la participación en vías de apoptosis, entre otros.17,19,20
Figura 3. Gen GDF5 y su participación en un interactoma por coexpresión, vecindad o genes fusionados.
Fuente: adaptado de STRING Database.20
De esta manera, el interactoma es una red de interacciones entre biomoléculas que no necesariamente tienen el mismo tipo o función. Muchos de estos interactomas están relacionados con diseasomas, los cuales son un grupo de enfermedades que se interrelacionan por sus orígenes genéticos; es decir, un gen (o grupo de ellos) se conecta a una enfermedad determinada a través de mutaciones y/o variantes genéticas. Teniendo en cuenta lo anterior, es posible suponer que la DCC y la OA podrían tener un origen genético compartido a través del GDF5, ya que estas dos enfermedades parecen originarse de un mismo módulo funcional por medio de dicho gen (Figura 4).21,22
Figura 4. Enfermedades relacionadas con osteoartritis y mutaciones en el gen GDF5 en el diseasoma.
Fuente: adaptado de Exploring Data.21
Mecanismos inflamatorios
Anteriormente, se pensaba que la OA era una enfermedad no inflamatoria debido a que no se identificaron datos bioquímicos de enfermedad inflamatoria en el líquido sinovial de pacientes con OA en comparación con el de pacientes con artritis reumatoide. Sin embargo, estas teorías se modificaron con el tiempo cuando se observó que pacientes con OA presentaron sinovitis con una inflamación semejante a la que evidenciada en pacientes con antecedente de trauma. Así, en la actualidad el proceso inflamatorio es considerado parte del origen y del progreso de la OA.23
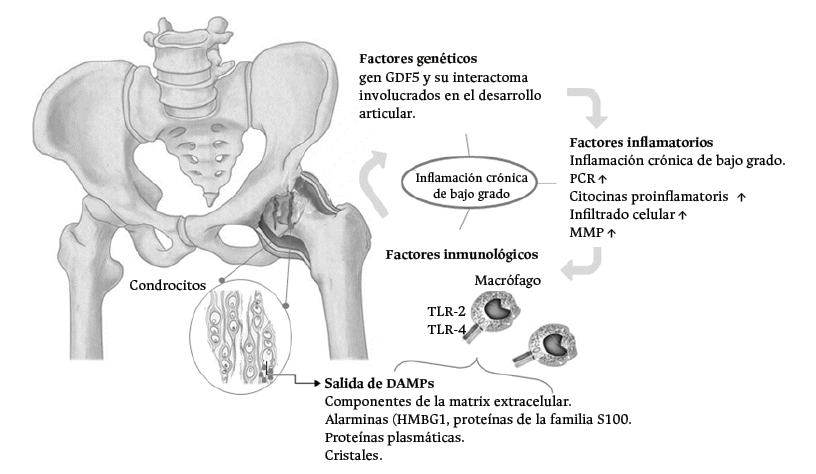
Los factores de riesgo de tener OA incluyen principalmente la edad, obesidad, presencia de trauma articular y trastornos biomecánicos. Todos estos factores de riesgo son considerados alteraciones biológicas que generan inflamación crónica de bajo grado y podrían ocasionar la destrucción articular de la cadera (Figura 5).23,24
DAMPs: patrones moleculares asociados a daño; GDF5: factor de diferenciación de crecimiento 5; HMGB1: proteína de alta movilidad del grupo 1; MMP: metaloproteinasas de la matriz extracelular; PCR: proteína C reactiva; TLR-2 y TLR-4: receptores tipo Toll.
Figura 5. Representación esquemática de los mecanismos fisiopatológicos asociados a displasia del desarrollo de la cadera y osteoartrosis.
Fuente: elaboración propia.
Se ha observado que los pacientes con OA presentan niveles séricos elevados de proteína C reactiva y de interleucina 6 (IL-6) en fluidos sinoviales, incluso antes de presentar los cambios radiográficos característicos del desgaste articular, como pérdida de cartílago, estrechamiento del espacio articular y la formación de osteofitos.23,25
También se ha descrito que, en la fase temprana de la OA, en una muestra de líquido sinovial se puede evidenciar el incremento de la cantidad de un infiltrado de células compuesto principalmente de macrófagos, mastocitos, células asesinas naturales (NK) y algunas células T y B, así como la elevación de los niveles de algunos mediadores inflamatorios como prostaglandinas y citosinas, lo cual es diferente en la fase tardía de la OA.23 Los mediadores inflamatorios podrían activar el proceso inflamatorio de manera no tradicional, ya que el cartílago articular no está vascularizado ni inervado, por lo que los condrocitos consiguen aumentar la producción de metaloproteinasas de matriz (MMP)
a través de dichas señales inflamatorias, degradando el cartílago en pequeños fragmentos que flotan en el líquido sinovial dentro de la articulación y exacerbando la inflamación.26
Otro mecanismo fisiopatológico relacionado con el proceso inflamatorio en la OA es la sobreexpresión de leptina, la cual es una hormona sintetizada principalmente por el tejido adiposo. De esta forma, se ha descrito que los pacientes con OA y obesidad pueden sobreexpresar leptina, estimulando una mayor expresión de interleucina-1 (IL-1), IL-6, MMP9 y MMP13, así como un aumento de la citotoxicidad de NK y la activación de neutrófilos, basófilos y eosinófilos.26,27 Por otro lado, estudios experimentales han encontrado que el proceso de acetilación y desacetilación de histonas del ácido desoxirribonucleico (DNA) de condrocitos humanos regula genes principalmente de MMP, los cuales participan en el catabolismo del cartílago bajo la influencia de IL-1, contribuyendo al daño de la articulación por infamación.28 En este sentido, podemos afirmar que la inflamación, específicamente la de bajo grado, tiene una influencia importante en la patogénesis de la OA.
Mecanismos inmunológicos
Algunos órganos y células del cuerpo humano son inmunológicamente privilegiados, lo cual significa que son capaces de tolerar la presencia de antígenos sin desencadenar una respuesta inflamatoria. Por lo anterior, se ha descrito que el tejido articular pertenece a esta categoría.29
El cartílago no contiene vasos sanguíneos ni sistema linfático o nervioso, por lo que se considera un tejido básico, pues solo contiene condrocitos, colágeno tipo II y proteoglicanos que se encargan de suministrar la resistencia hidráulica a las fuerzas mecánicas. La ausencia de vasculatura provoca que los condrocitos reciban nutrientes y eliminen material de desecho por difusión a través de la matriz extracelular desde y hacia el líquido sinovial, respectivamente. Por estas razones, cualquier tipo de lesión articular, ya sea congénita o adquirida, podría dificultar la reparación del cartílago, degradarlo y ocasionar OA.30
Como se mencionó en la sección anterior, las señales inflamatorias pueden incrementar la producción de MMP en la articulación y generar pequeños fragmentos de cartílago que flotan en el líquido sinovial, funcionando como patrones moleculares asociados a daño (DAMPs, por su sigla en inglés). Estos DAMPs son moléculas intracitoplasmáticas o nucleares liberadas de las células que sufrieron una apoptosis inmunogénica, exponiendo extracelularmente a sus componentes intracelulares y alertando al organismo para producir una respuesta inmune innata.23,26,31 Los DAMPs que han sido asociados a daño articular son fibronectina, hialuronano, alarminas, algunos cristales de fosfato de calcio y/o ácido úrico, proteínas plasmáticas, entre otros (Figura 4).23,26
Los DAMPs de la articulación estimulan la síntesis de citocinas proinflamatorias tales como IL-1β, IL-6, factor de necrosis tumoral alfa (TNFα), factor de crecimiento del endotelial vascular (VEGF), así como MMP1 y MMP3, provocando condrolisis. Del mismo modo, se ha reportado que los sitios con daño del tejido e inflamación podrían presentar fuga vascular y exudado de proteínas plasmáticas hacia el líquido sinovial, funcionando como DAMPs, ya que promueven la producción de macrófagos que se unen a receptores de reconocimiento de patrones, conocidos como receptores tipo Toll-2 (TLR-2) y Toll-4 (TLR-4), iniciando y promoviendo la OA.23,25,26
La activación del sistema del complemento es otra característica de la inmunidad innata que puede contribuir a dañar el cartílago, ya que se han encontrado concentraciones elevadas de estas proteínas en líquido sinovial de pacientes con OA. Esto ha sido demostrado mediante estudios proteómicos en los que se ha evidenciado la sobreregulación de genes que codifican proteínas del complemento, acompañada por la desregulación de moléculas inhibidoras de este mismo sistema.23
Por otro lado, el estrés oxidativo es otro mecanismo de inmunidad innata que puede causar la senescencia de condrocitos. De manera general, la senescencia en cultivos celulares puede ocurrir de dos formas: replicativa y secretoria. La senescencia replicativa se refiere a la disminución de la tasa de división celular en periodos de vigorosa proliferación, mientras que la senescencia secretoria alude a que las células pueden presentar baja capacidad de división celular, pero alta capacidad de síntesis de mediadores solubles.26 Los condrocitos pertenecen a esta última forma de senescencia, por lo que se considera que, cuando la persona envejece, sus condrocitos articulares caen en senescencia secretoria, estimulando la producción de IL-1β y MMP13, y ocasionando inflamación local y condrólisis, lo cual puede llevar al desarrollo de OA en la articulación.26
Discusión
Para el momento en que realizamos este estudio (febrero de 2023) y de acuerdo con nuestra búsqueda de evidencia, existen pocas publicaciones sobre los factores genéticos, moleculares y experimentales que posiblemente relacionan la DCC y la OA, y algunas de estas investigaciones no son concluyentes.6,9,14,15 No obstante, en la última década, las interacciones génicas han tomado relevancia, ya que muestran cómo diversos grupos de genes pueden participar en una misma vía funcional para constituir módulos dentro de la vía (between pathway module),32 de tal forma que una simple variación de un nucleótido en un gen podría alterar la vía. Un ejemplo claro de esto es lo que hemos señalado en esta revisión con respecto a la participación del gen GDF5 en la condrogénesis y la osteogénesis articular de manera activa.6,7 Cualquier alteración molecular en dicho gen podría provocar condrólisis y otras consecuencias en el cartílago, el hueso y el desarrollo articular.6,19
Sin embargo, no solo los factores genéticos están relacionados con la DCC y su predisposición a OA. Como hemos observado en el presente artículo, factores inflamatorios e inmunológicos desencadenan un proceso, originado quizás por la inestabilidad mecánica producida por la DCC, que causa inflamación crónica de bajo grado en todos los componentes articulares, la cual se manifiesta clínicamente como fibrosis, degradación del cartílago articular, engrosamiento del hueso subcondral, formación de osteofitos, sinovitis, degradación de meniscos y ligamentos, e hipertrofia capsular.1,6,15,33
Además, estudios de proteómica realizados en líquido sinovial han demostrado que existen nuevos biomarcadores, como la glicoproteína alfa-1-ácida (AGP1), la cual en la actualidad solo se suele evaluar esporádicamente, pues no constituye un marcador bioquímico analizado en exámenes rutina. La AGP1 participa tanto en vías inflamatorias como inmunológicas articulares en inflamación como en procesos inmunológicos de la articulación. Esto tiene importancia en el diagnóstico de OA, debido a que esta condición es considerada una enfermedad circunscrita a la articulación, lo cual significa que los niveles séricos demarcadores proinflamatorios son menores que los de marcadores medidos en líquido sinovial en estos pacientes.34 Por su parte, según pruebas de sangre, la proteína C reactiva es una de las pocas proteínas que se encuentra elevada en pacientes con OA, lo cual tiene una especial relevancia ya que se ha descrito que existe una correlación entre tener un nivel alto de esta proteína y el grado de infiltrado inflamatorio en las articulaciones del paciente.34
Por lo tanto, la DDC es una enfermedad que debe ser diagnosticada y tratada de manera oportuna, debido a que puede generar secuelas físicas que incluyen limitaciones de movimiento, acortamiento de la extremidad, claudicación, escoliosis, dolor, deformidades de rodilla, desgaste prematuro de la cadera contralateral, etcétera.2 En este sentido, dichas secuelas pueden producir discapacidad en el paciente o la condición puede llevar a la ocurrencia de complicaciones como la OA, la cual eventualmente requerirá la realización de una artroplastia de cadera, cuyos riesgos incluyen desde una infección superficial hasta fracturas femorales periprotésicas o trombosis venosa profunda, las cuales requieren un manejo del paciente en unidades de terapia intensivas.2
Por lo tanto, se recomienda realizar un seguimiento clínico y radiológico a los pacientes con DDC durante los primeros años de su vida para valorar la maduración ósea.4 Sin embargo, se debe tener en cuenta que en la actualidad no es posible predecir el desarrollo de OA según el antecedente de DCC, incluso en pacientes con caderas aparentemente sanas, pues ellos también pueden desarrollar esta condición.4 Ahora bien, investigaciones novedosas han propuesto que ciertos mecanismos genéticos, inflamatorios e inmunológicos podrían ser los responsables de iniciar, prolongar y mantener el daño articular en la cadera.26 En este sentido, conocer la fisiopatología de estas enfermedades favorecerá la implementación de novedosos tratamientos que mitiguen o solucionen el daño articular26 y se recomienda tener en cuenta marcadores bioquímicos séricos y en líquido sinovial para el seguimiento de DDC y OA.34
Conclusiones
La DDC ha sido considerada como una enfermedad puramente mecánica, debido a la presencia de inestabilidad y/o displasia de las estructuras óseas afectadas; sin embargo, dicha inestabilidad puede generar inflamación crónica de bajo grado con el transcurso del tiempo y llevar al desarrollo de OA en el adulto joven.23,26-28
A partir de la información disponible en la actualidad, se puede considerar que existe una relación muy estrecha entre la DDC y la OA que se presenta a temprana edad, puesto que el proceso mecánico de roce entre las articulaciones de la cadera y la cabeza femoral generan inflamación crónica mediante un proceso que involucra al sistema inmunológico innato y adaptativo.14,15 El proceso infamatorio crónico que se desarrolla es una respuesta del organismo al daño, con el que trata de reparar las estructuras involucradas; sin embargo, ante la persistencia del daño mecánico, se produce una condición de activación permanente de los sistemas inflamatorios que a su vez pueden ser la causa de los efectos nocivos a largo plazo.23,28
Además, el proceso de la inflamación crónica involucra la activación de los macrófagos junto con la elevación de citocinas proinflamatorias que mantienen el daño a las estructuras, ya que se generan elementos perjudiciales como los radicales libres derivados del oxígeno, los cuales, sumados a todo lo anterior, inician un proceso de degradación continua de la articulación.23,26-28
Los mecanismos fisiopatológicos de desarrollo de la DDC y la OA no son conocidos por completo; sin embargo, conocer las interacciones entre factores genéticos, inflamatorios e inmunológicos ayudará al médico tratante a establecer un diagnóstico oportuno y, de esta forma, permitirá brindar un tratamiento dirigido a disminuir y, de ser posible, controlar el daño a largo plazo, así como a mejorar la calidad de vida del paciente.
Conflictos de interés
Los autores declaran no tener ningún conflicto de intereses.
Financiación
La realización de esta revisión de la literatura contó con el apoyo económico del Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado.
Agradecimientos
Los autores agradecen los recursos materiales al Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado. Los autores agradecen la asistencia técnica de Sergio Hernández Rodríguez.
Referencias
1.Moraleda L, Albiñana J, Salcedo M, González-Moran G. Displasia del desarrollo de cadera. Rev. Esp Cir Ortop Traumatol. 2013;57(1):67-77. https://doi.org/f2jnrh.
2.Cymet-Ramírez J, Alvarez-Martínez MM, García-Pinto G, Frías-Austria R, Meza-Vernis A, Rosales-Muñoz ME, et al..
El diagnóstico oportuno de la displasia de cadera. Enfermedad discapacitante de por vida. Consenso del Colegio Mexicano de Ortopedia y Traumatología. Acta Ortop Mex. 2011;25(5):313-22. https://doi.org/kgrm.
3.Sarmiento-Carrera N, González-Colmenero E, Vázquez-Castelo JL, Concheiro-Guisán A, Couceiro-Naveira E,
Fernández-Lorenzo JR. Riesgo de displasia del desarrollo de la cadera en pacientes sometidos a versión cefálica externa . An Pediatr (Barc). 2018;88(3):136-9. https://doi.org/kgrn.
4.Nemeth BA, Narotam V. Developmental dysplasia of the hip. Pediatr Rev. 2012;33(12):553-61.
https://doi.org/ddfw4j.
5.Storer SK, Dimaggio J, Skaggs DL. Developmental Dysplasia of the Hip. Am Fam Physician. 2006;74(8):1310-6. https://doi.org/kgrp.
6.Hatzikotoulas K, Roposch A, Shah KM, Clark MJ, Bratherton S, Limbani V, et al.. Genome-wide association study of developmental dysplasia of the hip identifies an association with GDF5. Commun Biol. 2018;1:56. https://doi.org/kgsh.
7.Knut & Alice Wallenberg Foundation. The Human Protein Atlas. Suecia: 2003 [citado 15 de octubre 2021]. Disponible en: https://www.proteinatlas.org.
8.Lespasio MJ, Sultan AA, Piuzzi NS, Khlopas A, Husni ME, Muschler GF, et al.. Hip Osteoarthritis: A Primer Perm J. 2018;22:17-84. https://doi.org/gp5nn2.
9.Lievense AM, Bierma-Zeinstra SMA, Verhagen AP, Verhaar JAN, Koes BW. Prognostic factors of progress of hip osteoarthritis: a systematic review. Arthritis Rheum. 2002;47(5):556-62. https://doi.org/cfqrpc.
10.Leung, YY, Pua, YH, Thumboo J. A Perspective on Osteoarthritis Research in Singapore. Proc Singap Healthc. 2013;22(1), 31–9. https://doi.org/kgsj.
11.Fransen M, Bridgett L, March L, Hoy D, Penserga E, Brooks P. The epidemiology of osteoarthritis in Asia. Int J Rheum Dis. 2011; 14(2):113-121. https://doi.org/fhggmq.
12.de Andrade DC, Saaibi D, Sarría N, Vainstein N, Cano-Ruiz L, Espinosa R. Assessing the burden of osteoarthritis in Latin America: a rapid evidence assessment. Clin Rheumatol. 2022;41(5):1285-92. https://doi.org/grvf7d.
13.Terjesen T. Residual hip dysplasia as a risk factor for osteoarthritis in 45 years follow-up of late-detected hip dislocation. J Child Orthop. 2011;5(6):425-31. https://doi.org/d4q5wd.
14.Woetzel D, Huber R, Kupfer P, Pohlers D, Pfaff M, Driesch D, et al. Identification of rheumatoid arthritis and osteoarthritis patients by transcriptome-based rule set generation. Arthritis Res Ther. 2014;16(2):R84. https://doi.org/gb92fh.
15.Sokolove J, Lepus CM. Role of inflammation in the pathogenesis of osteoarthritis: latest findings and interpretations. Ther Adv Musculoskelet Dis. 2013;5(2):77-94. https://doi.org/f4vp59.
16.Mabuchi A, Nakamura S, Takatori Y, Ikegawa S. Familial osteoarthritis of the hip joint associated with acetabular dysplasia maps to chromosome 13q. Am J Hum Genet. 2006;79(1):163-68. https://doi.org/bwfs27.
17.Shwartz Y, Viukov S, Krief S, Zelzer E. Joint Development Involves a Continuous Influx of Gdf5-Positive Cells. Cell Rep. 2016;15(12):2577-87. https://doi.org/gh9qxr.
18.Page MJ, Moher D, Bossuyt PM, Boutron I, Hoffmann TC, Mulrow CD, et al. PRISMA 2020 explanation and elaboration: updated guidance and exemplars for reporting systematic reviews. BMJ. 2021;372:n160. https://doi.org/gjkrwz.
19.Degenkolbe E, König J, Zimmer J, Walther M, Reiner C, Nickel J, et al. A GDF5 point mutation strikes twice--causing BDA1 and SYNS2. PLoS Genet. 2013; 9(10):e1003846. https://doi.org/f9snwh.
20.ELIXIR Core Data Resources y Global Biodata Coalition. STRING CONSORTIUM. ELIXIR Core Data Resources y Global Biodata Coalition; 2020. [citado 13 de diciembre 2021]. Disponible en: https://string-db.org/.
21.Gómez R. Exploring Data. Gómez R; 2019 [citado 19 de diciembre 2021]. Disponible en: https://exploring-data.com/vis/human-disease-network/.
22.Goh KI, Cusick ME, Valle D, Childs B, Vidal M, Barabási AL. The human disease network. Proc Natl Acad Sci U S A. 2007;104(21):8685-90. https://doi.org/bt6qvc.
23.Sokolove J, Lepus CM. Role of inflammation in the pathogenesis of osteoarthritis: latest findings and interpretations. Ther Adv Musculoskelet Dis. 2013;5(2):77-94. https://doi.org/f4vp59.
24.González-Costa M, Padrón-González AA. La inflamación desde una perspectiva inmunológica: desafío a la Medicina en el siglo XXI. Rev Haban Cienc Méd. 2018;18(1):30-44.
25.Felson DT. Osteoarthritis as a disease of mechanics. Osteoarthritis Cartilage. 2013;21(1):10-5. https://doi.org/f2m64g.
26.Berenbaum F. Osteoarthritis as an inflammatory disease (osteoarthritis is not osteoarthrosis!). Osteoarthritis Cartilage. 2013;21(1):16-21. https://doi.org/f2m6p7.
27.Zeddou M. Osteoarthritis Is a Low-Grade Inflammatory Disease: Obesity’s Involvement and Herbal Treatment. Evid Based Complement Alternat Med. 2019;2019:2037484. https://doi.org/kgsp.
28.Rogers EL, Reynard LN, Loughlin J. The role of inflammation-related genes in osteoarthritis. Osteoarthritis Cartilage. 2015;23(11):1933-38. https://doi.org/f79jcg.
29.Fujihara Y, Takato T, Hoshi K. Macrophage-inducing FasL on chondrocytes forms immune privilege in cartilage tissue engineering, enhancing in vivo regeneration. Stem Cells. 2014;32(5):1208-19. https://doi.org/gr9c54.
30.Abazari A, Jomha NM, Elliott JAW, McGann LE. Cryopreservation of articular cartilage. Cryobiology. 2013;66(3):201-9. https://doi.org/f4vhs3.
31.Rojo-León V, Aguilar-Cázares D, Prado-García H, Carlos-Reyes Á, López-González JS. Participación de los patrones moleculares asociados al daño en el tratamiento convencional del cáncer. Rev Invest Clin. 2012;64(3):284-93.
32.Costanzo M, Kuzmin E, van Leeuwen J, Mair B, Moffat J, Boone C, et al. Global Genetic Networks and the Genotype-to-Phenotype Relationship. Cell. 2019;177(1):85-100. https://doi.org/gfw9gq.
33.Roh JS, Sohn DH. Damage-Associated Molecular Patterns in Inflammatory Diseases. Immune Netw. 2018;18(4):e27. https://doi.org/gd6rcx.
34.Sohn DH, Sokolove J, Sharpe O, Erhart JC, Chandra PE, Lahey LJ, et al. Plasma proteins present in osteoarthritic synovial fluid can stimulate cytokine production via Toll-like receptor 4. Arthritis Res Ther. 2012;14(1):R7. https://doi.org/fxrvc8.
 Liliana García-Ortiz2
Liliana García-Ortiz2 José Gutiérrez-Salinas3
José Gutiérrez-Salinas3 Tania Jazmín Ruiz-Sánchez4
Tania Jazmín Ruiz-Sánchez4